甲状腺病理诊断的免疫组化标志物
摘要
随着新的生物标志物的出现,免疫组化检测在甲状腺病变诊断中的应用也日益增多。在这篇综述中,我们讨论了对准确诊断、预后和处理至关重要的生物标志物。使用免疫组化标记来确认甲状腺中的不寻常肿瘤确实是甲状腺起源,不论是向滤泡上皮细胞还是C细胞分化; 多种类似病变包括非甲状腺病变,如甲状旁腺肿瘤、副神经节瘤、胸腺肿瘤和转移性恶性肿瘤。甲状腺滤泡上皮细胞的肿瘤可以使用多种免疫组化生物标志物进一步细分,这些免疫组化标志物可以区分滤泡细胞来源的病变与C细胞病变,以及其他支持恶性肿瘤的交界性病例。使用突变特异性抗体可区分携带BRAF V600E突变的乳头状癌与RAS样肿瘤。已经开发了免疫染色以进一步鉴定肿瘤发展潜在的分子改变,包括一些重排。在甲状腺癌中已知的表观遗传修饰的几种生物标志物的表达的改变可以用来帮助预测更具侵袭性的生物学行为,例如发展局部淋巴结扩散的倾向。免疫组化可以帮助识别淋巴和血管侵犯。生物标志物可用于确定去分化,并进一步分类低分化和间变性癌。与形成内分泌肿瘤的遗传易感性相关的罕见肿瘤也可以使用一些免疫组化染色来鉴定。这些辅助工具的应用允许更准确的诊断和更好地了解发病机制,同时提高甲状腺肿瘤患者的预测和预后。
引言
免疫组化在甲状腺病理学中的作用包括诊断的多个方面以及用于提供关于预后、预测和遗传易感性信息的生物标志物。
在某些情况下,需要免疫组化来证明甲状腺肿瘤的分化; 这需要鉴定甲状腺滤泡细胞或滤泡旁C细胞的生物标志物,或者相反,证明为分化不同的病变,如甲状旁腺细胞增生、来自甲状腺内胸腺或唾液腺残余的病变、间质或淋巴样病变,以及转移性恶性肿瘤。
一些生物标志物可用于正确分类已知细胞来源的甲状腺肿瘤。随着分子生物学的进步和对滤泡上皮细胞衍生的滤泡和乳头状病变认识的改变,一套免疫组化可用于区分良性与交界性或恶性病变。具有实体和小梁生长模式的滤泡上皮衍生的肿瘤也可以基于分化和粘附标记物的丧失而适当地分类。这些领域的进展正在产生对正确分类这些肿瘤有价值的信息。
甲状腺病理学的主要挑战之一是正确识别可能具有侵袭性生物学行为的肿瘤,以及将他们与保持惰性的肿瘤相鉴别。文献中描述了许多可以帮助预测生物学行为的形态和功能特征,有些可以用免疫组化加以鉴定。
最后,随着内分泌肿瘤的遗传基础变得越来越清晰,我们拥有的工具可以帮助病理学家确定需要作基因检测的患者,这是诊断病理学的一个重要方面,对患者和他们的家庭成员预防疾病起着关键作用。
在这篇综述中,我们总结了最重要的免疫组化生物标志物,可用于解决甲状腺病理学中的陷井。为了简洁起见,并未讨论所有的生物标志物。本文也未涉及甲状腺的间质和淋巴病变。
确认甲状腺病变的细胞来源
甲状腺肿瘤可以来源于滤泡上皮细胞,但它们也可能由滤泡旁C细胞和来自甲状腺内和周围的其他组织产生,包括甲状旁腺、胸腺和多种间质成分。 因此,重要的是有工具来确保病变的正确分类。 在这里,我们回顾了各种甲状腺特异性免疫组化生物标志物和那些鉴定甲状腺区域其他相关病变的标志物。
甲状腺转录因子
甲状腺转录因子(TTFs)的发现使我们有可能提高对甲状腺生物学的理解。甲状腺的实质细胞同时表达编码TTF蛋白的四个基因:由NKX2-1编码的Nkx-2.1,也称为甲状腺转录因子-1(TTF-1)和同源盒蛋白;FOXE1,也称为甲状腺转录因子-2(TTF-2)和由FOXE1编码的forkhead box蛋白;配对盒蛋白PAX8(由配对盒基因8(PAX8)编码);以及同源盒蛋白Hhex(由HHEX编码)。这四种转录因子在甲状腺滤泡细胞中表达,并在其他组织中选择性表达。在甲状腺中,TTFs调节甲状腺的发育,并调节甲状腺球蛋白、甲状腺过氧化物酶(TPO)、促甲状腺激素受体(TSHr)和甲状腺钠/碘协同转运蛋白的表达。因此,由于不利遗传事件导致TTF功能的改变,诸如突变和表观遗传修饰可能导致甲状腺发育不良甚至发展为肿瘤。
TTF也在全身的其他组织中表达。NKX2-1 / TTF-1在第四鳃囊、后鳃体、肺、气管、垂体后叶、下丘脑、内侧神经节隆起、C细胞、甚至甲状旁腺细胞中表达。 FOXE1 / TTF-2在来自咽弓和咽壁(舌头、腭和食道)、睾丸、表皮和毛囊的组织中表达; 在人胸腺、脑、心脏、胎盘、肺、骨骼肌和肾脏中也见有表达。 PAX8表达见于肾脏、宫颈内膜、子宫内膜、卵巢、输卵管、精囊、胰岛细胞和淋巴样细胞中。 HHEX表达可见于除甲状腺滤泡细胞以外的肝脏和造血细胞。
甲状腺转录因子-1
在甲状腺中,免疫组化证实TTF-1在正常甲状腺滤泡细胞和滤泡旁细胞的细胞核中弥漫性表达。因此,TTF-1在滤泡细胞衍生的肿瘤如滤泡性腺瘤、分化良好的滤泡性癌(乳头状和滤泡状)、低分化癌和C细胞增生性病灶以及几乎所有的髓样癌中显示弥漫性表达并不奇怪。在5%至15%的间变性癌中保留TTF-1表达,但通常是局灶性的。据报道,TTF-1在甲状腺的粘液表皮样癌和极少数伴有嗜酸性粒细胞增多的硬化性粘液表皮样癌病例中也有表达。除了转移性肺肿瘤(肺腺癌、分化良好的肺神经内分泌肿瘤)以及各部位的低分化神经内分泌癌病例,TTF-1可用于考虑转移性肿瘤的甲状
腺结节的鉴别诊断,尤其是当继发性肿瘤作为明显的甲状腺结节或转移至原发性甲状腺肿瘤(肿瘤至肿瘤转移)时。甲状腺球蛋白免疫反应性经常用于确认滤泡细胞来源。然而,应该意识到这种生物标志物的局限性,因为甲状腺球蛋白在某些甲状腺滤泡上皮增殖中有时可能是阴性的,或者弥散型染色可能对诊断医生造成诊断挑战(图1)。因此,建议使用TTF-1和单克隆PAX8。当鉴别原发性甲状腺肿瘤与转移到甲状腺的神经内分泌肿瘤时,降钙素免疫组化染色也可能只具有有限的价值,因为它在非甲状腺神经内分泌肿瘤中也可表达,尤其是肺起源的肿瘤。这种情况将需要与患者的原发肿瘤进行比较,仔细确定血清降钙素水平(与其他神经内分泌肿瘤相比,甲状腺髓样癌高得多)、癌胚抗原免疫组化染色(优选单克隆抗体)和分子遗传学。当区分转移到甲状腺的癌时,了解CDX-2在甲状腺乳头状癌的柱状细胞亚型中表达也很重要(图2)。
一些病灶中的TTF-1表达还可以取决于用于免疫组化的抗体的克隆。例如,据报道8G7G3 / 1克隆在被称为实体细胞巢的甲状腺的后鳃体残余中呈阴性或可不同程度的弱阳性。然而,最近的一项研究表明,TTF-1的SPT24克隆在甲状腺的后鳃体残余中呈现弥漫性强表达(图3)。同一项研究扩展了后鳃体残余的免疫组织化学特征,证实其GATA-3阳性和单克隆癌胚抗原(CEA)阴性,在某些病例,这些结构可能类似于滤泡上皮增生。
TTF-1在非肺神经内分泌癌中的表达已有报道,可见于卵巢、胃肠道、胰胆管和乳房发生的高级别肿瘤。
目前,确定甲状腺滤泡细胞来源的转移性肿瘤不仅限于福尔马林固定的石蜡包埋的组织病理学标本; 它也可以在细胞学标本中进行,如细胞离心涂片、细胞块和直接涂片。研究警示:抗体的免疫反应性可能会受到细胞学标本的影响,特别是那些固定在酒精类固定剂中的标本。因此,在细胞学标本中TTF-1抗体的应用只能在仔细分析验证后才能使用。

图1甲状腺球蛋白免疫组化。甲状腺球蛋白免疫反应通常被认为是确认滤泡细胞起源。然而,甲状腺球蛋白有时在一些甲状腺滤泡上皮增生中可能是阴性,以及弥散型染色可以产生诊断的挑战。这是单克隆CEA和降钙素(未显示)阳性的甲状腺髓样癌外周的显微照片,显示病灶外围滤泡上皮的真阳性染色(左)和C细胞病变边缘弥散型甲状腺球蛋白假阳性染色(中间),朝向病变中心逐渐消失(右)。

图3后鳃体残余物(实性细胞巢)。图示实性细胞巢(a)的p63(b)和TTF-1阳性(c)。了解TTF-1各种克隆的免疫组化反应性很重要,如已报道8G7G3/ 1克隆在实性细胞巢中呈现阴性的或可同程度弱阳性。然而,TTF-1的SPT24克隆(C)在后鳃体残余物中呈现弥漫性强表达。

图2柱状细胞亚型乳头状癌中CDX-2的反应性。将转移癌到甲状腺的癌与甲状腺原发癌相鉴别,重要的是要知道CDX-2在柱状细胞中也有表达。CDX-2在柱状细胞亚型乳头状癌中的反应性(a)甲状腺球蛋白阴性(未示出)。TTF-1阳性(B)和单克隆PAX8阳性(C)证实甲状腺滤泡肿瘤的上皮起源。

图4 PAX8在甲状腺间变性癌诊断中的作用。显微照片显示在低分化甲状腺癌背景下发生的间变性甲状腺癌(A左侧:间变性甲状腺癌)。间变性癌的甲状腺球蛋白(B)和TTF-1(C)为阴性,单克隆PAX8(D)阳性。
PAX8
在甲状腺中,PAX8的弥漫性强表达见于甲状腺滤泡上皮及其相关肿瘤; 在甲状腺髓样癌的病例中也报道了灶性弱表达(41%至75%的病例表现出弱阳性染色)。PAX8抗体染色呈阳性的非甲状腺肿瘤包括肾肿瘤、苗勒氏源性卵巢肿瘤、子宫内膜样癌和精原细胞瘤。有趣的是,在甲状旁腺病变和非肿瘤性胸腺组织的罕见病例中也报道了弥漫至弱阳性染色。根据本文(OM,SLA)的一些作者经验,采用多克隆抗血清在甲状旁腺和胸腺一些位点显示PAX8阳性,而使用单克隆抗血清则为阴性,表明所报道的反应性可能是非特异性的。
已经显示甲状腺间变性癌的病例常常保留PAX8的表达,有助于对TTF-1和细胞角蛋白的阴性表达病例的诊断(图4),特别是那些不伴有高分化甲状腺成分的间变性癌病例。 Bishop等人已经显示PAX8免疫染色也有助于鉴别显示鳞状分化的甲状腺间变性癌和头颈部鳞状细胞癌,因为后者PAX8为阴性。
甲状腺转录因子-2(FOXE1)
文献仅限于甲状腺和非甲状腺病变中TTF-2的表达。它在所有滤泡细胞起源高分化和低分化癌中呈弥散性强表达。据报道,在少数间变性癌和高达75%的甲状腺髓样癌病例中呈现局灶性弱表达,但不在其他可见TTF-1表达的器官中表达,尤其是肺源性肿瘤。
甲状腺球蛋白
甲状腺球蛋白(TG)是脊椎动物蛋白质组中最大的蛋白质之一,仅由甲状腺滤泡细胞合成。人类TG由染色体8q24.2-8q24.3编码,其单体分子量为330 kDa,大约由2750个氨基酸组成。TG基因的表达受TTF-1和PAX8的调控。TG以高度浓缩的形式储存在甲状腺滤泡的胞外胶质内。这种有效的存储系统是甲状腺的独特特征,它提供了甲状腺激素的随需应变的可行性,并避免了碘缺乏症的灾难性后果。TG的转录后修饰是碘化作用,导致T3和T4的合成,这一步是在甲状腺刺激素(TSH)刺激下通过钠碘转运体(NIS)、双功能氧化酶(DUO)和TPO的协调作用进行的。
血清TG的参考范围男性为1.40~29.2 ng/ml,女性为1.50~38.5 ng/ml,半衰期为65小时。甲状腺非肿瘤性和肿瘤性病变的血清TG水平均能升高。与良性疾病相比,滤泡源性甲状腺癌患者可显著增加。甲状腺切除后TG水平可用于监测局部肿瘤复发或远处转移,但这高度依赖于术后残留甲状腺组织的存在和恶性肿瘤的分化程度。
通过免疫组织化学,TG表达表明甲状腺滤泡起源; 然而,免疫组化染色强度和类型高度依赖于肿瘤类型。大多数甲状腺滤泡性癌和乳头状癌显示胞质弥漫性强表达,伴腔内胶质的强染色。在嗜酸细胞(Hürthle细胞)肿瘤病例,TG免疫组化染色可以表现为局限于核周区域的致密颗粒状沉积物,而有些病例可能表现为灶性弱表达。在低分化甲状腺癌中TG表达相对降低,并且在间变性癌中总是缺失。大多数C细胞衍生的病变不表达TG; 而甲状腺髓样癌的罕见病例可能显示TG抗体的局灶性免疫染色,这一特征很可能是由于肿瘤内包裹的滤泡上皮或弥散型染色,包括在巨噬细胞和血管内的TG染色。称为混合或复合髓样和滤泡/乳头状癌的罕见甲状腺肿瘤的C细胞和滤泡细胞衍生成分会真正分别地表达降钙素和TG。在本文的一些作者(OM,SLA)的经验中,使用单克隆PAX8和降钙素可用于确认复合性甲状腺髓样癌和滤泡上皮来源癌的诊断(图5)。
细针抽吸标本中的TG表达也可用于确认滤泡细胞来源,特别是在临床上类似孤立性甲状腺结节的继发性肿瘤或身体其他部位的转移性甲状腺肿瘤病例。此外,从颈部淋巴结抽吸物测定TG水平可以确定转移性癌的甲状腺滤泡细胞来源。这对甲状腺乳头状癌囊性转移的非诊断性细针抽吸(FNA)标本非常有益。然而,建议TG与TTF-1和单克隆PAX8联合使用。

图5 混合性髓样-滤泡亚型乳头状癌。肿瘤结节由双细胞群组成(a)。C细胞对降钙素(b)呈阳性反应,而滤泡成分对单克隆PAX8呈阳性(c)。这两种成分对TTF-1都是阳性(d)。
甲状腺过氧化物酶
TPO是分化性甲状腺细胞特异性表达的酶。 有助于将细胞定义为甲状腺滤泡细胞分化。
降钙素
在二十世纪六十年代初期,了解C细胞疾病有两大进展,包括激素降钙素的发现和甲状腺髓样癌(MTC)的病理描述。在1966年,威廉姆斯假设髓样癌可能来源于C细胞,如果是的话,可能会产生降钙素,这可能是一种很好的肿瘤生物标志物。 Bussolati和Pearse在1967年通过使用免疫荧光技术证明C细胞中降钙素的存在,从而证实了这一概念。
降钙素(CT)是一种由32个氨基酸组成的高效低钙血症多肽激素。 CALC-1基因编码人CT; 它是CALC基因家族的成员,位于11号染色体短臂的顶端(11p15.3-15.5)。降钙素通过与在成人组织中广泛表达的特异性CT受体结合发挥其功能。有趣的是,CT受体表达也可见于肺的神经内分泌肿瘤以及乳腺和前列腺的恶性肿瘤中。证明血清降钙素水平(基础和刺激)升高仍然是诊断散发性和家族性甲状腺髓样癌的敏感和特异性试验。已经显示血清降钙素与MTC的大小相关。然而,随着肿瘤去分化,CT可以降低而CEA升高。同样,病理标本(细针穿刺和组织病理学)中MTC的形态学诊断通常通过使用免疫组化证实CT表达来确认。 高达95%的MTC免疫组化染色显示CT阳性; 然而,染色模式可以不同,从弥漫到灶性染色,高达25%的病例仅显示灶性表达。
少数MTC病例可能无法检测到的血清降钙素水平,然而,通过免疫组化,这些肿瘤将显示降钙素弥漫性强表达到灶性弱表达。一些专家认为,CT的丢失预示着预后不良,然而,其他专家未能证实这种联系。降钙素原可作为降钙素阴性肿瘤中的有用标记,同样,降钙素基因相关肽也可以作为CT阴性MTC的生物标志物。
降钙素基因相关肽
降钙素/降钙素基因相关肽(CGRP)基因负责产生降钙素和α-CGRP。 CT是在甲状腺C细胞中合成的主要肽,而α-CGRP在包括血管周围神经纤维、三叉神经节、硬脑膜非血管成分和小脑的神经组织中广泛表达。已经鉴定了一种由独立基因编码的被称为β-CGRP的类似肽。 MTC可以通过免疫组化和原位杂交技术检测α-CGRP的表达。 此外,它也可以在MTC患者的血清中检测到。
MTC的其他生物标志物
除CT和CGRP外,C细胞也表达CEA、嗜铬粒蛋白和TTF-1。 CEA染色见于灶性C细胞增生,并且对CT灶性弱表达或阴性的MTC病例非常有用。 由于单克隆CEA在所有C细胞增殖中实际上都是阳性的,因此它被认为是MTC的最佳生物标志物(图6)。 已经表明,与降钙素相比,在长期随访中CEA可能是MTC的较好的生物标志物。 从身体其他部位(通常是肺和胃肠道)发生的神经内分泌肿瘤转移到甲状腺可以在形态学上与MTC相似。 因此,CT、CGRP、CEA和TTF-1以及嗜铬粒蛋白A和S100染色很重要。

图6 CEA是甲状腺髓样癌的最佳生物标志物。显微照片显示单克隆CEA在降钙素不同程度阳性的甲状腺髓样癌(未出示)中的反应性。
非滤泡细胞和C细胞来源的原发性甲状腺肿瘤免疫表型
甲状腺副神经节瘤
原发性甲状腺副神经节瘤(TPGL)很罕见,形态学上可与MTC,甚至与具有实体和岛状生长模式的滤泡细胞起源的肿瘤相似。根据欧美头颈部副神经节瘤登记处的研究结果,TPGL的患病率为0.5%(944例头颈副神经节瘤病例中有5例TPGL),除1例外,均可能携带胚系SDHX突变。在此分析中,大多数病例嗜铬粒蛋白A、突触素和S100阳性,且几乎全部都对降钙素和TTF-1呈阴性。 Castel Blanco等人提出了一组基于cDNA结果的免疫组化生物标志物,除了CGRP /降钙素,CEA和TTF-1之外,还包括NDUFA4L2、COXIV2和VMAT2以诊断TPGL。根据这些作者的研究,CT或CGRP的低表达与阴性表达,结合NDUFA4L2,COXIV2或VMAT2的任何表达最能提示TPGL。一个更简单的方法是使用GATA-3和酪氨酸羟化酶,因为相当大比例的TPGL也有这两种生物标志物的表达,而且,可能更容易获得。TPGL缺乏角蛋白表达这一点非常重要,因为GATA-3也在嗜铬粒蛋白A阳性的甲状旁腺肿瘤中表达。
GATA-3是双锌指转录因子的成员,其参与包括甲状旁腺、肾脏、辅助性T细胞的Th2亚群、乳腺、交感神经系统和表皮角质形成细胞在内的多种器官的发育。迄今为止,使用GATA3抗体的病理学研究已显示其在许多组织中的表达,包括甲状旁腺、乳腺、尿道上皮、生殖细胞肿瘤、副神经节瘤和一部分肾肿瘤。 GATA-3免疫反应性不见于正常甲状腺滤泡上皮细胞、C细胞或后鳃体残余,以及良性和恶性甲状腺肿瘤,除外少数间变性癌病例,因为其在高度增殖性肿瘤中倾向于表观遗传学上失调。
酪氨酸羟化酶是芳香族氨基羟化酶,催化酪氨酸向多巴胺的转化。这是儿茶酚胺合成中的限速步骤。酪氨酸羟化酶的免疫表达与嗜铬粒蛋白免疫组化染色阳性以及与形态学相结合被认为对于副神经节细胞瘤是诊断性的。然而,酪氨酸羟化酶的免疫反应性可能很弱且可变。而且,与交感神经起源的副神经节瘤(胸腰椎副神经节瘤)相比,在副交感神经起源的副神经节瘤(头颈部副神经节瘤)中甚至罕见地阴性。值得注意的是,酪氨酸羟化酶也在TT(MTC)细胞系中表达,并且已有报道在1例有角蛋白和TTF-1表达的MEN2综合征患者的MTC 病例中表达。因此,结合GATA-3反应性和角蛋白和其他转录因子反应性的缺失,酪氨酸羟化酶反应性支持副神经节细胞分化。
甲状腺内甲状旁腺腺瘤
甲状旁腺肿瘤通常发生在正常解剖部位的甲状旁腺。然而,这些肿瘤性增殖也会影响甲状腺内或紧贴甲状腺的甲状旁腺腺体,类似于甲状腺结节。甲状腺内甲状旁腺的发病率范围从1.4到3.2%(尸检研究中为0.2%)。在甲状旁腺功能亢进的检查过程中,甲状腺内甲状旁腺的存在可以通过影像学(特别是超声波)检测,在评估甲状腺结节过程中不太可靠。甲状腺内甲状旁腺肿瘤由于其成像特征可以通过超声诊断,并且通过锝-99m-sestamibi闪烁显像进一步证实。
事实证明,FNA有助于诊断考虑可能为甲状腺内甲状旁腺的病变。这个程序在对FNA标本进行甲状旁腺激素(PTH)检测,或对细胞块进行免疫组化研究时最为有效。用于确认甲状旁腺来源并将甲状旁腺与甲状腺肿瘤区分开的诊断性免疫组化包括PTH、嗜铬粒蛋白、GATA-3、TTF-1和甲状腺球蛋白。在细胞学和组织病理学标
本中GATA-3用于诊断甲状旁腺病变的效用比PTH免疫染色的特异性更高,其可以显示甲状旁腺肿瘤亚群中的局灶性和弱阳性。但是,必须记住GATA-3也可以在其他肿瘤包括肾癌和乳腺癌、副神经节瘤和淋巴瘤中表达。使用GCM2,甲状旁腺的主要调节剂之一,也被证明能够可靠地区分甲状旁腺起源。
甲状腺内胸腺残余和肿瘤
胸腺和下甲状旁腺分别发育自第三和第四鳃囊,并且从妊娠第2周到第6周迁移至正常解剖位置。在迁移过程中,胸腺前体可以嵌入称为胸腺咽道的区域的各种组织中,这通常会在以后退化。异位胸腺组织可能由于沿着胸咽道的异常迁移,隔离或持续的胸腺组织而发展。异位甲状旁腺胸腺残余在成年人中很少见,通常无症状,偶尔在甲状腺结节影像学检查或手术切除的甲状腺组织病理检查期间发现。甲状腺内的胸腺残余可能会对细针抽吸标本造成诊断困难,并可能被误认为慢性淋巴细胞性甲状腺炎或淋巴细胞增生病变。由甲状腺内甲状腺残余所引起的肿瘤很少见,包括胸腺瘤、胸腺样分化的梭形上皮肿瘤(SETTLE)和甲状腺胸腺癌(以前称为显示胸腺样分化的癌“CASTLE”)。甲状腺肿瘤中的胸腺分化可以通过一系列免疫染色来确认。这些肿瘤通常对TTF-1、PAX8、TG和CT呈阴性。甲状腺内胸腺瘤CKpan、CK5 / 6、EMA、p63、CD5和C-kit阳性。在胸腺瘤中观察到的淋巴细胞成分通常表现出CD3和TdT的表达,并且B细胞标记物的染色呈阴性。 SETTLE对AE1 / AE3、CAM5.2、EMA、CK7、波形蛋白和CD117(C-kit)呈阳性。甲状腺的胸腺癌易被鉴定为恶性肿瘤,其panCK、CD5、BCL-2、p63和CD117(C-kit)阳性。
甲状腺肿瘤分类
滤泡细胞起源的甲状腺肿瘤的诊断是复杂的,并且受到观察者间差异的影响。理想的是有生物标记物能够解决交界性特征,并能够区分不同诊断实体。在这篇综述中,我们将提供证据,证明生物标志物有助于良性(a)和恶性滤泡生长模式肿瘤(b)、经典和滤泡亚型乳头状癌(PTCs)、实体和低分化甲状腺癌以及间变性癌( d)与肉瘤和鳞状细胞癌的鉴别。
滤泡性病变
多年来,甲状腺的滤泡性肿瘤一直分为良性滤泡性结节疾病、滤泡性腺瘤、滤泡亚型PTC和滤泡癌。明显的侵犯性病变很容易被识别,区分滤泡亚型PTC和滤泡癌是学术性层面,可能没有必要。同样,区分滤泡性腺瘤与滤泡性结节性病变也是学术性的。然而,良性与恶性病变的区别在患者处理中至关重要。不幸的是,这是最激烈的分歧之一。缺乏共识主要是因为基于细胞学特征的恶性肿瘤分类中,对核膜不规则的价值意见不一。虽然很容易辨认毛玻璃样核与核内假包涵体的典型核异型性,但是一些更细微的变化难以分类。在一项关于乳头状癌细胞核三维特征的研究中,Papotti等人根据先前的形态测量分析定义了标准,随后,Asioli等人提供了一种生物标志物,可用于区分圆形和不规则核。该生物标志物尚未在临床实践中广泛采用。

图7甲状腺病理分子免疫组化。VE1抗体可用于鉴别BRAF V600E驱动的甲状腺癌(a)。RAS突变特异性抗体也可用于各种甲状腺肿瘤,包括散发性RAS驱动的甲状腺髓样癌。NRAS61QR免疫组化显示RAS突变型甲状腺癌中的细胞质染色(b)。ALK免疫组化在检测ALK融合驱动的甲状腺乳头状癌中也获得了广泛的应用(c)。

图8用于支持甲状腺滤泡性恶性肿瘤的通用生物标记物。HBME-1是最常用的免疫组化标记物。膜和腔缘染色传统上被认为是支持恶性肿瘤(a,b)。然而,功能性甲状腺结节和NIFTP(以前称为非侵袭性包裹性滤泡性乳头状癌)也可以阳性。虽然大多数BRAF样乳头状癌表现出对HBME-1(a)的反应性,但RAS样乳头状癌倾向于阴性或可变阳性(b)。弥漫性膜质和细胞质细胞角蛋白19(c)和CD56阴性表达(d)也可见于滤泡上皮起源的甲状腺恶性肿瘤。半乳糖凝集素-3的核和胞质反应性也扩大了恶性肿瘤生物标志物的谱系(e)。
为了解决诊断不一致的问题,内分泌病理学协会的一个工作组试图确定与非浸润性包裹性和境界清楚的滤泡性肿瘤中的恶性行为相关的核特征。该倡议的结果推荐术语“伴乳头样特征的非浸润性滤泡性甲状腺肿瘤(NIFTP)”,为区分RAS样滤泡性肿瘤和BRAF样典型乳头状甲状腺癌提供了指南,如TCGA基于核形态学的乳头状癌研究。然而,这种区别也存在形态结构要求,随后的研究指出乳头作为诊断NIFTP的排除标准的重要性; 尽管最初有人提出乳头<1%,但很快就证明甚至单个乳头的存在可预示具有BRAF V600E突变的肿瘤,容许存在<1%的乳头会将以滤泡结构为主的经典型乳头状癌归入NIFTP范畴。既然任何经典PTC比RAS样滤泡性肿瘤具有较高的局部淋巴结转移风险,因而推荐进一步进行研究,包括使用针对BRAF V600E突变的VE1抗体,其特征见于约70%的经典PTC,用于确保RAS样病变的正确分类。因此,使用VE1的免疫组化目前在区分具有滤泡生长模式为主的经典型PTC以及任何BRAF V600E突变型甲状腺癌中起主要辅助作用; RAS突变特异性抗体在这方面是否有价值仍有待观察(图7a,b)。 RET免疫组化在PTC诊断中的应用随着可靠抗血清的丧失而下降,但它仍然是分化性甲状腺癌潜在的分子分类的有用工具。
人们已提出许多其他生物标志物来辅助诊断甲状腺滤泡型生长模式的恶性肿瘤(图8)。 HBME-1是一种识别未知表位的单克隆抗体,被普遍认为是有用的。即使作为一种神秘的蛋白质,HBME-1能在一定比例的甲状腺癌中可靠表达,包括乳头状癌和滤泡癌以及NIFTPs。该生物标志物在滤泡性病变中的价值最高,其有助于将这样的肿瘤分类为恶性肿瘤,并且可能具有预后价值。同样,galectin-3在支持恶性肿瘤诊断方面具有价值。 CD56表达的缺失也是进展性甲状腺肿瘤的一个特征。另外一个有趣的生物标志物是细胞角蛋白19(CK19),该蛋白在非肿瘤性甲状腺中表达,在滤泡性肿瘤中表达不足或呈阴性,并在PTC中表达强烈的膜阳性,包括一些具有滤泡结构的PTC 。CK19的染色需要不同于用于判断其他生物标志物阳性与阴性的标准定性解释。
乳头状病变
甲状腺中乳头状病变的鉴别通常是鉴定是否是乳头状癌。绝大多数乳头状肿瘤属于经典型乳头状癌,其中有不同数量的滤泡成分。分子研究表明,大多数这些病变具有BRAF V600E突变,虽然可以通过使用免疫组化和VE1突变特异性抗体来证实,但这在临床和诊断上都是不必要的。缺乏这种突变的肿瘤可能有RET重排,同样也可以通过免疫组织化学检测,但同样没有临床意义。
乳头状结构可见于罕见的良性肿瘤、滤泡性腺瘤,其与GNAS或TSHR的激活突变相关,该激活突变导致自主活动过度和可能与临床或亚临床甲亢相关的肿瘤。因为完整滤泡内乳头的组织结构和良性核形态,这些病变通常在常规组织学上即可辨认; 然而,对于疑难病例,可以应用免疫组化来显示这些肿瘤缺乏HBME-1、CK19、半乳糖凝集素-3和VE1染色。
据报道,具有经典结构的PTC的一种亚型,弥漫性硬化亚型,具有ALK重排,可通过免疫组化检测ALK(图7c)。
另一种PTC亚型,即筛状-桑葚亚型,通常表现出复杂的生长模式,除了筛状、滤泡和实体结构之外,还可以包括乳头状生长。对该亚型的识别具有临床意义,因为PTC的这种组织学亚型可以与家族性腺瘤性息肉病(FAP)综合征的APC中的胚系突变相关联。 β-连环蛋白(beta-catenin)染色(图9)显示了由于活化的WNT信号传导引起的核移位并且可以证实筛状-桑葚亚型的诊断。罕见的是散发性和带有编码β-连环蛋白的CTNNB1体细胞突变的病例。
实性病变
具有实性结构的甲状腺肿瘤包括实体亚型PTC、MTC和低分化或“岛状”甲状腺癌。 免疫组化对于基于嗜铬粒蛋白、降钙素和CEA的表达来诊断MTC是至关重要的。 实性亚型PTC与低分化癌的区别需要组织学特征,包括细胞大小和核形态以及有丝分裂和坏死的鉴定。 然而,其他生物标志物可以在鉴别诊断中起作用。 根据我们的经验,低分化甲状腺癌显示bcl-2、膜性E-钙粘蛋白和β-连环蛋白以及甲状腺球蛋白的丧失,以及p53核反应性的增加(图10)。 使用磷酸化组蛋白-H3染色可以有助于有丝分裂计数,使用MIB-1抗体进行Ki67标记有助于鉴定增殖更为活跃的病变(图10)。 透明梁状肿瘤也可以通过MIB-1染色的膜性表达来区分(图11)。
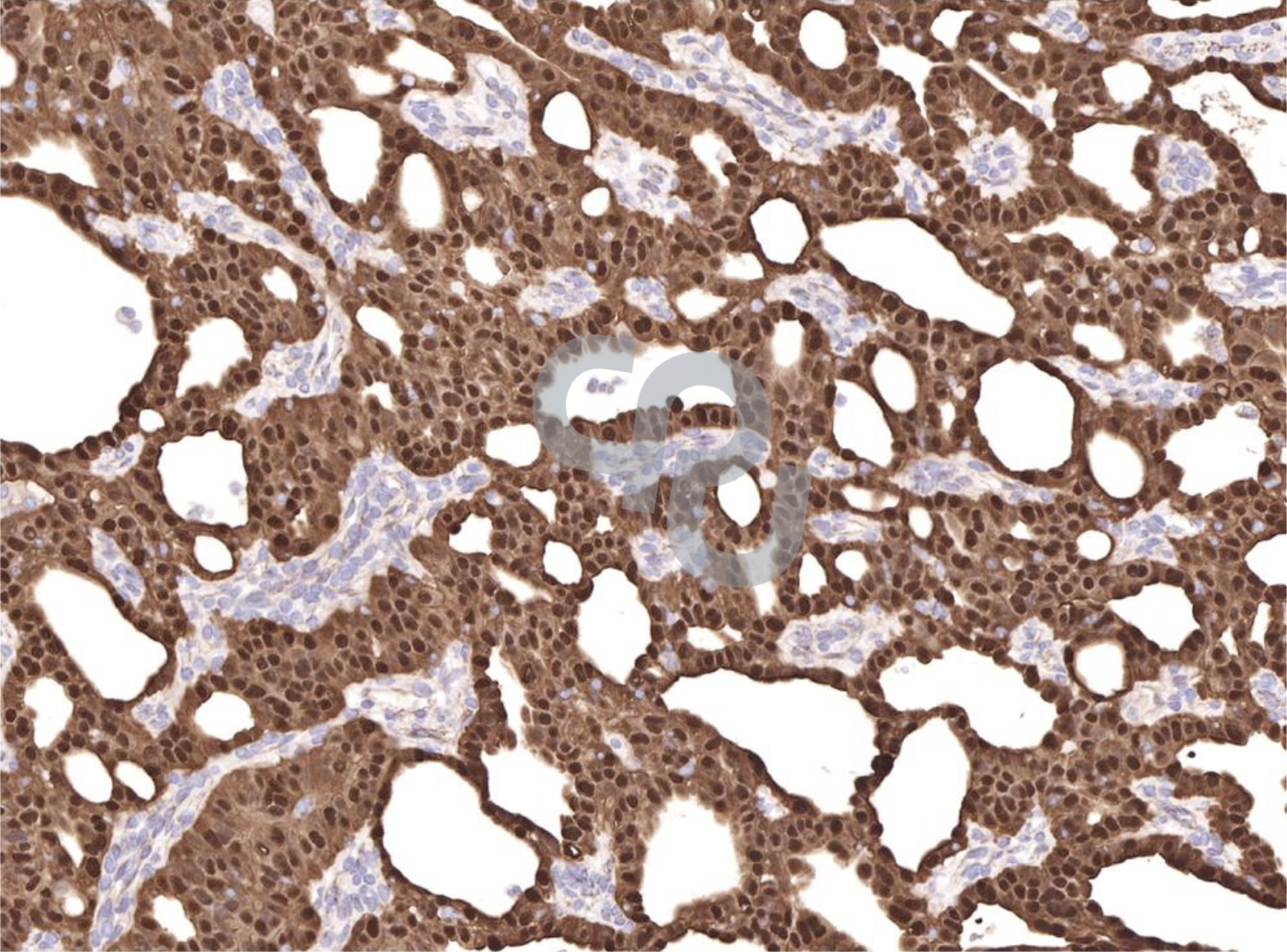
图9 筛状-桑椹亚型乳头状甲状腺癌。这种罕见的乳头状甲状腺癌的特点是β-连环蛋白弥漫性核和细胞质染色。这种亚型的诊断可能是FAP综合征的先兆。
梭形细胞和巨细胞病变
当甲状腺间变性癌与分化较好的甲状腺癌相关联并且具有明显的进展和去分化时,很容易诊断。 免疫组化证实疾病进展伴随甲状腺球蛋白、bcl-2、E-钙粘蛋白和β-连环蛋白的丢失; p53增高; 并最终丧失TTF-1,然后丧失PAX8的反应性。 如前所述,PAX8的反应性可见于甲状腺间变性癌的一个亚群以及甲状腺原发性鳞状细胞癌。 在没有分化性肿瘤的病例,间变性癌是需要排除的诊断之一,并且需要广泛的免疫组化检测来排除其他梭形细胞和巨细胞肿瘤。

图10低分化甲状腺癌的免疫组化标记物。分化型甲状腺癌中常伴有低分化甲状腺癌区域,虽然大多数情况下可以使用都灵共识中定义的形态学评价来分类,但生物标志物的应用有助于疑难病例的诊断。磷酸组蛋白-H3显示有丝分裂活性的增加(a;圆圈内为有丝分裂),MIB-1(常>10%),甲状腺球蛋白(b)、Bcl-2(c)和E-cadherin(d)表达减少,以及p53表达和核β-连环蛋白表达的增加(非筛状-桑椹亚型甲状腺乳头状癌病例)有助于诊断。
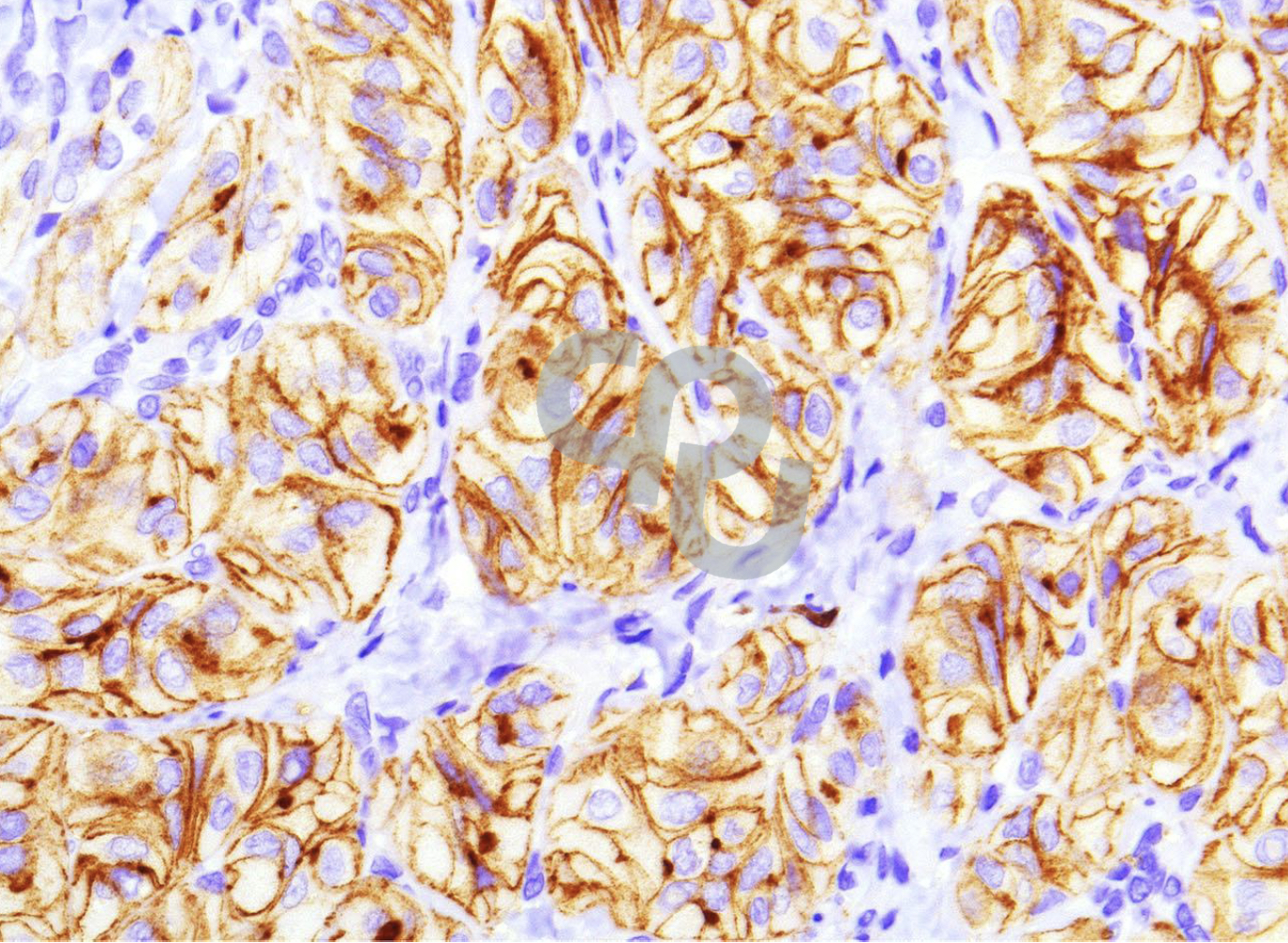
图11反常的MIB-1膜性表达是透明梁状甲状腺肿瘤的特征。MIB-1免疫组化染色通常需要在室温下进行。
原发性甲状腺恶性肿瘤的预后特点
分化良好的甲状腺癌往往是惰性的癌症,适合用放射性碘靶向治疗。然而,一些发生局部区域淋巴结转移,另外一些局部复发,少数发生远处转移的病例具有显著的发病率和死亡率。可以通过手术治愈的局部肿瘤必须与需要甲状腺全切除,以便放射性碘进一步治疗的病例相鉴别,这是甲状腺肿瘤学面临的最大挑战。
人们已提出一些免疫组化生物标志物可以用来预测分化良好的甲状腺癌的生物学行为。与已知在这些癌症中突变的驱动基因形成对比,涉及生物学行为的改变大部分是由于表观遗传失调造成的。上调的基因包括CITED1、半乳凝素-3、CK19和高分子量细胞角蛋白、CD57和CD44V6,以及HBME-1检测到的神秘蛋白; 在分化型甲状腺癌中下调主要见于CD56。这些生物标志物可能具有预后价值。
细胞周期调节因子p27和细胞周期蛋白D1(cyclin D1)失调,肿瘤抑制因子p27的缺失和乳头状癌中和细胞周期蛋白D1的过表达可能导致淋巴结转移(图12)。 p27的表达可能是通过miRNAs表观遗传的,但是通过Skp2降解的PTEN介导的翻译后处理可以被维生素D抑制。
纤连蛋白在局部浸润性肿瘤中也过表达,MAGE-A、CEACAM1和介导CD44v6和CEACAM作用的骨桥蛋白也是如此。 ERβ表达也在更具侵袭性的经典PTC中上调。
Rap1(Ras-proximate-1或Ras相关蛋白1)是一种GTP酶,可作为与RAS类似的推定癌基因。它受Rap1 GTPase活化蛋白(GAP)Rap1GAP的调控。该基因在PTC中下调,但该基因的甲基化状态尚未报道。
由分化的甲状腺癌引起的远处转移性扩散的最佳预测因素之一是脉管侵犯。事实上,在甲状腺中,肿瘤之间预后明显不同。在表现出淋巴侵袭的肿瘤,所述淋巴侵袭扩散到局部区域淋巴结并且可以用放射性碘治愈;而具有血管侵犯的肿瘤扩散到肺、骨、脑和肝脏。淋巴管与血管侵犯的评估可能需要使用生物标志物,例如D2-40(图13),其显示淋巴通道,而CD31、CD34和ERG突出血管。在三种血管标志物中,ERG是最具特异性的,并具有清晰的染色。由于真正的血管侵袭诱导体内血栓反应,特异性染色纤维蛋白和纤维蛋白原的免疫定位可能有帮助。
其他预后特征包括分化的生物标志物丢失,差分化癌的甲状腺球蛋白和NIS降低,间变性癌几乎丧失所有的分化标志物。
在MTC中,降钙素丢失而保留CEA阳性与侵袭性更强的行为相关联。 Ki67作为增殖标志物在这种类型的神经内分泌肿瘤和其他甲状腺肿瘤中的作用仍有待验证。

图12 P27和细胞周期蛋白D1的风险分级。p27(a)的丢失和细胞周期蛋白D1(b)的过表达可预测甲状腺乳头状癌的淋巴结转移。

图13淋巴管侵犯与血管侵犯的鉴别。 这是分化型甲状腺中最重要的区别之一。 滤泡上皮起源癌的血管通道可以使用ERG免疫组化来显示,而D2-40可以用于显示淋巴道。 显微照片显示淋巴管侵犯(a:H&E,b:D2-40)。
遗传易感性的鉴定
甲状腺肿瘤的遗传易感性越来越被认为是病理学家可以预测的一个指征。这种类型的遗传分析的第一项研究开始于多发性内分泌肿瘤2型患者的C细胞增生的鉴定,该诊断完全依赖于免疫组化证实。尽管许多MEN2患者表现出旺炽型C细胞增生(图14),瘤变表现为这种疾病的进展,但有些病例通过鉴别甲状腺手术中无关病变的C细胞增生来诊断。这要求在甲状腺侧叶的所有切片中检测CEA和/或CT。IV型胶原的免疫组化检测可以为结节性C细胞增生与浸润性髓样微小癌的鉴别提供帮助,IV型胶原可显示滤泡的基底膜。
与甲状腺肿瘤相关的其他家族综合征包括PTEN失活突变导致的PTEN错构瘤肿瘤综合征(Cowden综合征、Cowden样综合征、Bannayan-Riley-Ruvalcaba综合征、Proteus综合征和Proteus样综合征)和由于胚系APC突变导致的家族性结肠息肉病(FAP)综合征。患有Cowden综合征或其他PTEN相关疾病的患者会出现多灶性滤泡性肿瘤,并且PTEN染色可以确认可导致该疾病的PTEN整体丧失(图15)。一些作者还推荐使用SDHB免疫组化,因为已经在具有PTEN野生型Cowden和Cowden样综合征的患者中也发现了SDH基因的胚系突变或变异。
FAP患者通常会发生筛状-桑椹亚型乳头状癌,具有β-连环蛋白的核移位,有助于诊断,并且通常指示为胚系疾病; 然而,也有散发病例的报道。

图14双侧和多灶性C细胞增生是胚系RET疾病的(MEN2综合征)标志。图示甲状腺切除标本中偶然发现的结果。双侧C细胞旺炽性增生(a)导致胚系RET试验阳性。采用降钙素免疫组化清晰突出C细胞的线性和微结节性增生(b)。

图15 PTEN免疫组化染色在PTEN错构瘤肿瘤综合征中的表达。PTEN在多发结节中的整体丢失是PTEN -错构瘤肿瘤综合征的特征。星号显示结节性增生;请注意非增生性甲状腺组织保留PTEN的表达,如同非肿瘤性实质成分。
结论
虽然大部分甲状腺病变的诊断都是基于苏木精和伊红染色组织切片的镜检,免疫组化在确保甲状腺结节的正确诊断、确定预测生物学行为的标志物方面具有重要作用,并具有鉴定疾病的遗传易感性的潜力。